L’Agence européenne des médicaments pourrait autoriser la mise sur le marché européen à la fin du mois de janvier.
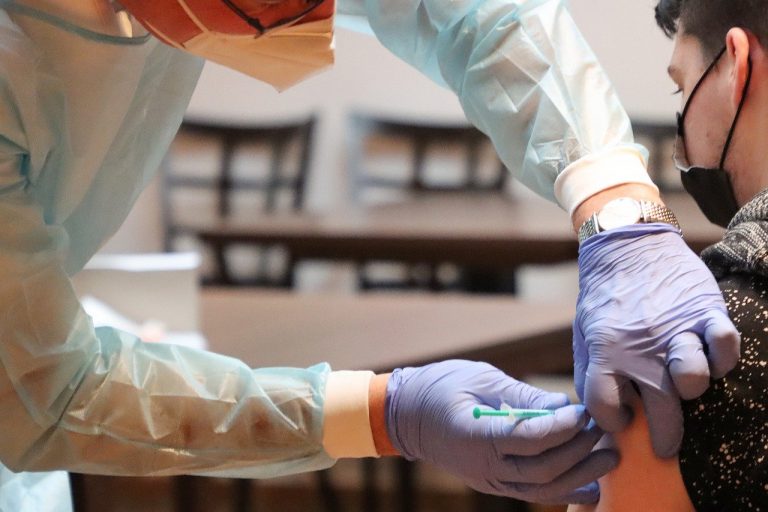
« L’Agence européenne des médicaments a reçu une demande d’autorisation pour une mise sur le marché conditionnelle du vaccin contre le Covid-19 développé par AstraZeneca et l’univestité Oxford », indique le EU Medicines Agency, dans un communiqué publié ce mardi. La décision d’approuver le vaccin AstraZeneca en Europe pourrait être rendue le 29 janvier.
Le vaccin AstraZeneca
Déjà délivré au Royaume-Uni et en Argentine, le vaccin AstraZeneca est le premier dont les résultats d’efficacité avaient été validés par la revue scientifique The Lancet.
Il a toutefois connu ensuite un retard de diffusion, lié à des résultats intermédiaires peu convaincants au mois de novembre. Une étude supplémentaire avait alors été lancée, mais l’agence européenne des médicaments ne précise pas si les résultats de celle-ci lui sont d’ores et déjà parvenus.
Pourquoi une autorisation pour l’Europe?
Pourquoi la mise sur le marché du vaccin AstraZeneca en Europe piétine-t-elle autant, alors que les Britanniques se font administrer le même vaccin depuis le 4 janvier? Selon l’EMA, le régulateur britannique avait approuvé le vaccin « dans le cadre d’une utilisation d’urgence, distincte d’une autorisation de mise sur le marché » européen.
Selon la responsable scientifique de l’Organisation mondiale de la santé, l’immunité collective contre le Covid-19 ne sera toutefois pas atteinte en 2021. « Nous n’allons pas atteindre (…) l’immunité collective en 2021 », a-t-elle lancé lors d’un briefing à Genève, soulignant l’importance de continuer à appliquer les mesures de protection comme la distanciation physique, le lavage des mains et le port du masque pour contrôler la pandémie.



Laisser un commentaire